Kimyada, bir elektronun temel enerji seviyesi elektronun atomun çekirdeğinde bulunduğu yere göre belirlenir ve buna göre kabuk veya yörünge denir. Bu seviye asal kuantum sayısı olan n ile gösterilir. Periyodik tabloda bir periyottaki ilk element yeni bir enerji seviyesine geçiş yapıldığını gösterir.
Enerji Seviyeleri ve Atom Modeli
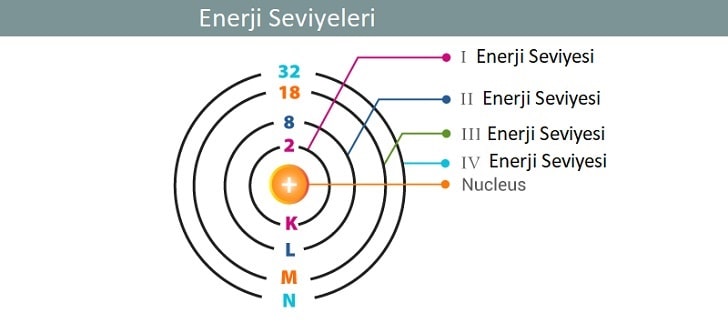
Enerji seviyeleri, atomik spektrumların matematiksel olarak analiz edilmesiyle oluşturulan bir atomik modelin bir parçasıdır. Bir atomdaki her elektron, pozitif yüklü atom çekirdeği ve diğer negatif yüklü elektronlarla ilişkili olarak belirlenen bir enerji seviyesine sahiptir.
Bir elektron enerji seviyelerini değiştirebilir, ancak bu sürekli artışlarla olmaz, sadece kademeli veya kademesiz olarak artış gösterir. Enerji seviyesinin enerjisi çekirdekten uzaklaştıkça artar. Birincil enerji seviyesinin sayısı ne kadar düşük ise, elektronlar birbirine ve atom çekirdeğine o kadar yakındır. Kimyasal reaksiyonların gerçekleştiği sırada, bir elektronu düşük enerji seviyesinden daha yüksek bir enerji seviyesine çıkarmak zordur.
Temel Enerji Seviyesi Kuralları
Temel enerji seviyesinde 2 n2 kadar elektron bulunabilir, n her seviye için elektron sayıdır.
İlk enerji seviyesi en fazla 2 *12 yani 2 elektron içerebilir ;
İkinci enerji seviyesi en fazla 2*22 yani 8 elektron içerebilir ;
Üçüncü enerji seviyesi en fazla 2*32 yani 18 elektron içerebilir.
- İlk temel enerji seviyesi alt enerji seviyesi olarak s orbitali adı verilen bir yörünge içerir. S orbitalinde maksimum 2 elektron bulunabilir.
- Bir sonraki temel enerji seviyesi 1 s orbitali ve 3 p orbitali içerir. Üç p orbitali toplamda altı elektron tutabilir. Böylece, ikinci temel enerji seviyesi, ikisi s orbitalde ve altısı p orbitalinde olmak üzere toplam 8 elektron tutabilir.
- Üçüncü temel enerji seviyesi, bir s orbitali, 3 p orbitali ve 5 d orbitali içerir. Bu enerji seviyesinde maksimum 18 elektrona tutulabilir.
- Dördüncü ve daha yüksek enerji seviyeleri s, p ve d orbitallerine ek olarak bir f orbitali de içerirler. F alt orbitalinden 7 tane vardır ve toplamda 14 elektrona kadar tutabilirler. Dördüncü ana enerji seviyesinde toplam 32 elektron bulunur.
Elektron Gösterimi
Enerji seviyesinin türünü ve bu seviyede toplam kaç elektron bulunduğunu göstermek için;
temel enerji seviyesi sayısı için bir katsayı,
alt seviye için bir harf
alt seviye içinde bulunan elektron sayısı için bir üst simge bulunur.
Örneğin, 3p2 üçüncü enerji seviyesini, s orbitali ve p orbitali içinde 2 elektron bulunduğunu gösterir.
Tüm enerji seviyelerindeki elektron sayısını ve atomun alt orbitallerini yazarak atomun elektron konfigürasyonunu bulabiliriz.
Hazırlayan: Rabiye Baştürk
Kaynak: 1 (Erişim: 14 Temmuz 2019) 2 (Erişim: 14 Temmuz 2019)