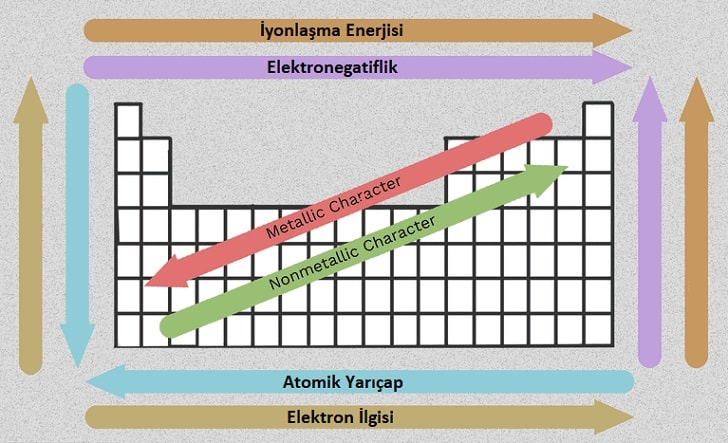
Periyodik eğilimler, belirli bir elementin boyutu ve elektronik özellikleri dahil olmak üzere farklı özelliklerini gösterir. Başlıca periyodik eğilimler şunlardır: elektronegatiflik, iyonlaşma enerjisi, elektron ilgisi, atomik yarıçap, erime noktası ve metalik karakterdir. Periyodik tablo düzenlenirken periyodik eğilimler dikkate alınmıştır. Bu eğilimler, gruplar veya periyotlar nedeniyle benzer atomik yapıdaki elementler arasında görülür.
Elektronegativite Eğilimleri
Elektronegativite, bir atomun elektronları çekme ve bunlara bağlanma yeteneğini tanımlayan kimyasal bir özelliktir. Elektronegatiflik nitel bir özellik olduğu için elektronegatiflik hesaplanırken standart bir yöntem kullanılmaz. Elektronegatifliği ölçmek için kullanılan en yaygın ölçek, kimyager Linus Pauling’in adını taşıyan Pauling ölçeğidir. Pauling ölçeği tarafından atanan sayılar elektronegatifliğin niteliksel yapısı nedeniyle boyutsuzdur. Her element için elektronegatiflik değerleri bu şekilde düzenlenmiş periyodik tablolarda bulunabilir.
Elektronegatiflik, bir atomun elektronlarla bağ kurma ve çekme eğilimini ölçer. Bu özellik, atomların elektronik konfigürasyonundan kaynaklanmaktadır. Çoğu atom oktet kuralına (valansa sahip olmak veya dış yörüngede 8 elektron bulundurmak) uyar. Periyodik tablonun sol tarafındaki elementler yarı tam değerlik kabuğuna sahip olduğu için elektron almak için gereken enerji, elektron vermek için gereken enerjiye kıyasla önemli ölçüde daha fazladır. Sonuç olarak, periyodik tablonun sol tarafındaki elementler genellikle bağ oluştururken elektron verirler. Periyodik tablonun sağ tarafındaki elementler, 8 elektronlu tam bir değerlik kabuğu oluşturmak için elektron alırlar.
ÖNEMLİ NOT: Bir atom elektron almaya ne kadar eğimliyse, atomun elektronları kendine doğru çekme olasılığı o kadar artar.
- Bir periyotta soldan sağa gidildikçe elektronegatiflik artar. Bir atomun değerlik kabuğu yarıdan az doluysa, bir elektron vermek için gereken enerji bir elektron almaktan daha az enerji gerektirir. Ancak değerlik kabuğu yarıdan fazla doluysa, bir elektron vermek için gereken enerji bir elektron almak için gereken enerjiden fazladır.
- Bir grupta yukarıdan aşağıya gidildikçe elektronegatiflik azalır. Bunun nedeni, atom numarası grupta artar ve dolayısıyla değerlik elektronları ile çekirdek arasındaki mesafe veya başka bir ifade ile atom yarıçapı artar.
- Yukarıdaki kuralların istisnaları arasında asal gazlar, lantanitler ve aktinitler bulunur. Soy gazlar tam değerlik kabuğuna sahiplerdir ve genellikle elektronları çekmezler. Lantanitler ve aktinitler, genellikle herhangi bir eğilimi takip etmeyen daha karmaşık bir kimyasal yapıya sahiplerdir. Bu nedenle asal gazlar, lantanitler ve aktinitlerin elektronegatiflik değerleri yoktur.
- Geçiş metalleri elektronegatiflik değerlerine sahip olmalarına rağmen, periyot boyunca veya grup boyunca aşağı veya yukarı gidildiğinde elementler aralarında çok az farklılık bulunmaktadır. Bunun nedeni metallerin, elektronları diğer elementlerden daha kadar kolay çekme yeteneğine sahip olmalarıdır.
ÖNEMLİ NOT: Bu iki genel eğilime göre, en elektronegatif element 3,98 Pauling birimi ile flordur.
İyonlaşma Enerjisi Eğilimleri
İyonlaşma enerjisi, bir elektronu gaz halindeki nötr bir atomdan ayırmak için gereken enerjidir. Kavramsal olarak iyonlaşma enerjisi, elektronegatifliğin tam tersidir. Bu enerji ne kadar düşükse, atom o kadar kolay bir katyon haline gelmektedir. Bu nedenle bu enerji ne kadar yüksekse, atomun katyon olma olasılığı o kadar düşüktür. Genel olarak, periyodik tablonun sağ tarafındaki elementler daha yüksek iyonlaşma enerjisine sahiptir çünkü değerlik kabukları neredeyse doludur. Periyodik tablonun sol tarafındaki elementler, elektron verme ve katyon oluşturma nedeniyle düşük iyonlaşma enerjisine sahiptir.
ÖNEMLİ NOT: İyonlaşma enerjisi periyodik tabloda soldan sağa doğru artar.
İyonlaşma enerjisini etkileyen bir diğer faktör de elektron korumadır(tutma). Elektron koruma, bir atomun iç elektronlarının pozitif yüklü çekirdeğini değerlik elektronlarından koruma yeteneği olarak tanımlanır. Bir periyotta sağa gidildikçe elektron sayısı artar ve elektron tutma gücü artar. Sonuç olarak, değerlik kabuğu elektronlarının iyonize olması daha kolaydır ve bu nedenle iyonlaşma enerjisi grupta aşağı inildikçe azalmaktadır.
ÖNEMLİ NOT:
• Elementlerin iyonlaşma enerjisi genellikle soldan sağa doğru artar. Bu, değerlik kabuğu stabilitesinden kaynaklanmaktadır.
• Bir grup içindeki elementlerin iyonlaşma enerjisi genellikle yukarıdan aşağıya doğru azalır. Bu, elektron korumasından kaynaklanmaktadır.
• Soy gazlar, tam değerlik elektronuna sahip oldukları için çok yüksek iyonlaşma enerjilerine sahiplerdir. Helyum en yüksek iyonlaşma enerjisine sahip elementtir.
Bazı elementlerin birkaç tane iyonlaşma enerjisi vardır. Değişen bu enerjiler; birinci iyonizasyon enerjisi, ikinci iyonizasyon enerjisi, üçüncü iyonizasyon enerjisi olarak adlandırılır.
- Birinci iyonizasyon enerjisi, en dıştaki veya en yüksek enerjili elektronu koparmak için gereken enerjidir.
- İkinci iyonizasyon enerjisi, daha sonraki yüksek enerjili elektronları gaz halindeki bir katyondan uzaklaştırmak için gereken enerjidir.
İlk İyonlaşma Enerjisi:
X( g) →X+(g) +e- (1)
İkinci İyonlaşma Enerjisi:
X+(g) →X2+(g) +e- (2)
Genel olarak, sonraki iyonlaşma enerjileri (2., 3., vb.), ilk iyonlaşma enerjisi ile aynı periyodik eğilimi izler.
ÖNEMLİ NOT: Atom yarıçapları arttıkça iyonlaşma enerjileri azalır.
Elektron Afinite Eğilimleri
Afinite (elektron ilgisi), bir atomun bir elektronu alma yeteneğidir. Elektronegatifliğin aksine elektron afinitesi, nötr bir gaz atomuna bir elektron eklendiğinde oluşan enerji değişiminin niceliksel bir ölçümüdür. Elektron afinite değeri ne kadar negatif olursa, bir atomun elektron afinitesi o kadar yüksek olur.
Elektron afinitesi genellikle bir grupta aşağı gidildikçe azaltır çünkü her atom üstündeki atomdan daha büyüktür (atomik yarıçap büyüklüğü). Bu eklenen elektronun, atomun çekirdeğinden daha küçük atomdaki konumuna kıyasla daha uzakta olduğu anlamına gelmektedir. Negatif yüklü elektron ile pozitif yüklü çekirdek arasında daha büyük bir mesafede çekim gücü nispeten daha zayıftır. Bu nedenle elektron ilgisi azalır. Bir periyot boyunca soldan sağa gidildikçe çekim gücü arttıkça atomlar küçülür. Bu durumda elektron çekirdeğe daha yakın hareket eder. Elektron afinitesini soldan sağa doğru artar.
ÖNEMLİ NOT:
• Elektron ilgisi bir periyotta soldan sağa gidildikçe artar. Bunun nedeni atom yarıçapındaki azalmadır.
• Elektron ilgisi bir grupta yukarıdan aşağıya gidildikçe azalır. Bunun nedeni atom yarıçapındaki artıştır.
Atomik Yarıçap Eğilimleri
Atom yarıçapı, iki atom çekirdeği arasındaki mesafenin yarısıdır (tıpkı bir yarıçapın, bir dairenin çapının yarısı olması gibi). Ancak tüm atomlar birbirine aynı şekilde bağlı olmadıkları için karmaşık durumlar oluşabilmektedir. Bazıları kovalent bağlarla bağlanır, bazıları iyonik bağlarla birbirlerine çekilir ve bazılarıysa metalik bağlarla bir arada kalır. Elementlerin büyük bir çoğunluğu kovalent moleküller oluşturur. Bu moleküllerin kovalent yarıçaplarına, atomik yarıçaplar denir. Bu mesafe pikometre cinsinden ölçülür.
Atom boyutu, bir periyotta soldan sağa gidildikçe yavaş yavaş azalır. Bunun nedeni, periyot boyunca tüm elektronlar aynı yörüngeye elektron ekler. Ayrıca, protonlar çekirdeğe eklenerek pozitif yüklü hale gelir. Proton sayısının artışında gözlemlenen etki, elektron sayısının artmasındaki etkiden daha büyüktür. Bu nedenle daha büyük bir nükleer çekim vardır. Bu, çekirdeğin elektronları daha güçlü çekmesi ve atom kabuğunu çekirdeğe yaklaştırması anlamına gelmektedir. Değerlik elektronları atomun çekirdeğine daha yakın tutulur ve bu nedenle atom yarıçapı azalır.
ÖNEMLİ NOT:
• Atom yarıçapı bir periyotta soldan sağa gidildikçe azalır. Bunun nedeni periyot boyunca proton ve elektron sayısındaki artıştır. Bir protonun, bir elektrondan daha büyük bir etkisi vardır. Bu nedenle elektronlar çekirdeğe doğru çekilerek daha küçük bir yarıçap oluşturur.
• Atom yarıçapı bir grupta yukarıdan aşağıya gidildikçe artar. Bunun nedeni elektron korumasıdır.
Erime Noktası Eğilimleri
Erime noktası, bir maddenin katı fazını sıvıya dönüştürürken bağ ve bağları kırmak için gereken enerji miktarıdır. Genel olarak, bir elementin atomları arasındaki bağ ne kadar güçlüyse, o bağı koparmak için o kadar fazla enerji gerekir. Sıcaklık enerji ile doğru orantılı olduğu için yüksek bağ ayrışma enerjisi de yüksek sıcaklıkla ilişkilidir. Erime noktaları çeşitlilik gösterir ve genellikle periyodik tablo boyunca ayırt edilebilir bir eğilim oluşturmaz.
ÖNEMLİ NOT:
- Metaller genellikle yüksek erime noktasına sahiptir.
- Çoğu ametal düşük erime noktalarına sahiptir.
- Karbon en yüksek erime noktasına sahip ametaldir. Bor en yüksek bir erime noktasına sahip yarımetaldir.
Metalik Karakter Eğilimleri
Bir elementin metalik karakteri, bir atomun bir elektronu ne kadar kolay verebileceği şeklinde tanımlanabilir. Bir periyot boyunca sağdan sola gidildikçe metalik karakter artar çünkü değerlik elektronu ile çekirdek arasındaki çekim daha zayıftır ve elektronları vermek daha kolaydır. Bir grupta aşağı doğru gidildikçe metalik karakter artar çünkü atom boyutu artar. Atom boyutu arttığında dış yörüngeler daha uzak bir konuma gelir. Temel kuantum sayısı artar ve ortalama elektron yoğunluğu çekirdekten uzaklaşır. Değerlik kabuğundaki elektronları çekirdek daha az çeker ve sonuç olarak elektronlar daha kolay verilir. Bu durum metalik karakterde bir artışa neden olur.
ÖNEMLİ NOT:
• Metalik özellikler bir periyotta soldan sağa gidildikçe azalır. Bu, dış elektronların daha kolay iyonize olmasını sağlayan atomun yarıçapındaki azalmadan kaynaklanır.
• Metalik özellikler bir grupta yukardan aşağı gidildikçe artar. Elektron koruma atom yarıçapının artması ile azalır böylece dış elektronlar daha küçük atomlardaki elektronlardan daha kolay iyonize olur.
• Metalik karakter elektron kaybetme yeteneği ile ilgilidir. Metalik olmayan karakter elektron kazanma yeteneği ile ilgilidir.
Metalik karakter 1.Grup, 2.Grup veya diğer bir ifade ile alkali ve alkali toprak metal gruplarına gidildikçe artar. Aynı şekilde periyodik tablonun sağ üst köşesine doğru yukarı ve sağa doğru gidildikçe metalik karakter azalır.
ÖRNEK SORULAR:
Soru 1. Hangi element en yüksek iyonlaşma enerjisine sahiptir?
- Flor (F)
- Azot (N)
- Helyum (He)
Çözüm: Helyum (He)
Açıklama: Helyum (He) en yüksek iyonlaşma enerjisine sahiptir çünkü diğer soy gazlar gibi helyumun da değerlik kabuğu doludur. Bu nedenle helyum kararlıdır ve kolayca elektron kaybetmez veya kazanmaz.
Soru 2. Nitrojen, oksijenden daha büyük bir atom yarıçapına sahiptir. Bu bilgi doğru mu yanlış mı?
- Doğru
- Yanlış
Çözüm: Doğru
Açıklama: Atom yarıçapı periyodik tabloda sağdan sola doğru artar. Bu nedenle nitrojen, oksijenden daha büyük atom yarıçapına sahiptir.
Soru 3. Hangisi daha fazla metalik karaktere sahiptir?
- Kurşun (Pb)
- Kalay (Sn)
Çözüm: Kurşun(Pb)
Açıklama: Kurşun ve kalay aynı grupta yer alırlar. Metalik bir grupta aşağı gidildikçe artar. Kurşun, kalayın altındadır bu nedenle kurşunun daha metalik karaktere sahiptir.
Soru 4. Hangi element daha yüksek erime noktasına sahiptir?
- Klor (Cl)
- Brom (Br)
Çözüm: Brom (Br)
Açıklama: Ametallerde erime noktası bir grupta aşağı gidildikçe artar. Klor ve brom aynı grupta bulunduğu için ve klor bromun üzerinde olduğu için brom daha yüksek erime noktasına sahiptir.
Soru 5. Hangi element daha elektronegatiftir?
- Sülfür (S)
- Selenyum (Se)
Çözüm: Kükürt (S)
Açıklama: Kükürt ve selenyumun aynı grubda yer alır. Elektronegatiflik bir grupta yukarıdan aşağı inildikçe azalır, bu nedenle sülfür selenyumdan daha elektronegatiftir.
Soru 6. Asal gazların elektronegatiflik değeri neden genellikle sıfırdır?
Cevap: Asal gazların çoğu tam değerlik kabuğuna sahiptir.
Açıklama: Tam değerlik elektron kabuklarından dolayı soygazlar son derece kararlıdır ve kolayca elektron vermez veya almazlar.
Soru 7. Si, Al, Mg, S elementleri azalan çekirdek çekim gücüne göre nasıl sıralanır?
Cevap: S> Si> Al> Mg
Açıklama: Yörüngedeki elektronlar kabuk tarafından korunur. S, son kabuğunda 6 elektron bulundurur bu nedenle her bir elektron, çekirdekteki 6 proton tarafından çekilir.
Soru 8. Flor (F), fosfor (P), sülfür (S), bor (B) elementleri azalan elektron afinitesine göre nasıl sıralanır?
Cevap: Flor (F)> Kükürt (S)> Fosfor (P)> Bor (B)
Açıklama: Elektron ilgisi genellikle soldan sağa ve aşağıdan yukarıya doğru artar.
Soru 9. Atom yarıçapı sülfürden (S) daha küçük olan bir atom aşağıdakilerden hangisidir?
a. Oksijen (O)
b. Klor (Cl)
c. Kalsiyum (Ca)
d. Lityum (Li)
e. Yukarıdakilerden hiçbiri
Cevap: Oksijen (O)
Açıklama: Atom yarıçapı bir grupta yukarıdan aşağı gidildikçe ve bir periyotta soldan sağa doğru gidildikçe artar. Bu nedenle oksijen, kükürtten daha küçük atom yarıçapına sahip elementtir.
Soru 10. Aynı periyottaki bir ametal, bir metale kıyasla daha küçük iyonik yarıçapa sahiptir. Bu bilgi doğru mu yanlış mı?
- Doğru
- Yanlış
Cevap: Yanlış
Açıklama: Bir metal iyon haline gelirken genellikle bir elektron verir ve bir ametal elektron alır. Bu durumda metal iyonu daha küçük bir iyonik yarıçapa sahip olurken, ametal iyonu daha büyük bir iyonik yarıçapa sahip olur.
Hazırlayan: Rabiye Baştürk


