Yanma, fermantasyon ve cevherlerin metallere indirgenmesi gibi kimyasal reaksiyonlar antik çağlardan beri bilinmektedir. Maddelerin birbirine dönüşümüne dair ilk teoriler Yunan filozofların tarafından geliştirilmiştir. Bu teori, Dört Element Teorisi’dir ve ateş, su, hava ve toprağı temel elemenler olarak kabul eder. Ortaçağ’da, kimyasal dönüşümler simyacılar tarafından incelenmiştir. Bu dönüştürme işlemi genellikle kurşun- altın ve kurşun-bakır alaşımları elde edilme amacı ile yapılmıştır. Bu alaşımlar reaksiyonlarda kullanılmıştır.
Doğada kendiliğinden meydana gelmeyen kimyasal maddelerin üretilmeye çalışılmıştır. Simyacı Cabir ibni Hayyam sülfürik ve nitrik asit sentezi, sülfat ve bakır sülfat, şap ve güherçile gibi nitrat minerallerinin ısıtılması gibi çalışmalarda bulunmuştur. 17. yüzyılda Johann Rudolph Glauber, sülfürik asit ve sodyum klorürü reaksiyona sokarak hidroklorik asit ve sodyum sülfat üretti. Kurşun haznesi prosesi geliştirilerek 1746 yılında Leblanc prosesi elde edildi. Bu proses ile büyük ölçekli sülfürik asit ve sodyum karbonat üretimine geçilerek endüstriyel kimyasal reaksiyonlar gerçekleştirilmiştir. Sülfürik asit teknolojisinin daha fazla optimize edilmesi ile 1880’lerde temas prosesi (Contact) ile geliştirildi, 1909-1910’da ise amonyak sentezi için Haber- Bosch prosesi geliştirildi.
16. yüzyıldan itibaren Jan Baptist van Helmont, Robert Boyle ve Isaac Newton da dahil olmak üzere çeşitli araştırmacılar deneysel olarak gözlemlenen kimyasal dönüşümlerin teorilerini oluşturmaya çalıştı. Filojiston teorisi 1667 yılında ortaya atılmıştır Johann Joachim Becher tarafından ortaya atılmıştır. Yanıcı cisimler içinde bulunan ve yanma sırasında salınan “phlogiston” adlı ateş benzeri bir element olduğu ifade edildi. 1785’te yanma olayının havadaki oksijen nedeniyle gerçekleştiğini açıklayan Antoine Lavoisier tarafından Filojiston teorinin yanlış olduğu kanıtladı.
Joseph Louis Gay-Lussac, 1808’de gazların her zaman belirli bir düzen içerisinde tepki gösterdiğini kabul etti. Bu fikre ve atomik teoriye dayanarak, John Dalton , Joseph Proust geliştirdiği Sabit oranlar kanunu geliştirdi sonradan stokiyometri ve kimyasal denklemleri açıkladı.
Organik kimyada, canlı organizmalardan elde edilen bileşiklerin sentetik olarak elde edilemeyecek kadar karmaşık olduğuna uzun zamandır inanılıyordu. Canlıcılık kavramına göre organik madde bir “yaşam gücü” ile donatıldı ve inorganik malzemelerden bu şekilde ayırt edildi. Friedrich Wöhler’in katkısı ile üre ve inorganik maddeleri ayırmak organik kimyaya büyük katkı sağlamıştır. 1828 Alexander William Williamson ve Christopher Kelk Ingold eter sentezi mekanizmasını keşfederek çeşitli reaksiyonları gerçekleştirmişlerdir.
Kimyasal Reaksiyon Tanımı
Kimyasal reaksiyon, kimyasal dönüşümün olduğu bir süreçtir. Kimyasal reaksiyonlar, çekirdeklerde herhangi bir değişiklik olmadan atomlar arasında kimyasal bağların oluşması ve kırılması sonucunda elektronların pozisyonlarındaki değişiklikleri içerir. Nükleer kimya, bu kimyasal reaksiyonlar dışındaki çekirdek bozunmalarını kapsayan kimyasal reaksiyonları içeren alt kimya dalıdır. Hem elektronik hem de nükleer değişiklikler sonucunda radyoaktif elementler oluşur.
Kimyasal reaksiyona başlangıçta katılan maddeye (veya maddelere) reaktanlar veya reaktifler denir. Kimyasal reaksiyonlar kimyasal değişikliğe neden olur ve genellikle reaktanlardan farklı özelliklere sahip bir veya daha fazla ürün oluşturur. Kimyasal reaksiyonlar başlangıç maddelerini, son ürünleri, bazen ara ürünleri ve reaksiyon koşullarını sembolik olarak gösteren kimyasal denklemlerle tanımlanır.
Kimyasal reaksiyonlar, belirli bir sıcaklıkta ve konsantrasyonda karakteristik bir reaksiyon hızında meydana gelir. Reaksiyon oranları sıcaklık artışıyla artar, çünkü atomlar arasındaki bağları koparmak için gerekli aktivasyon enerjisine ulaşmak için daha fazla termal enerji gerekir.
Reaksiyonlar, tamamlanana veya dengeye ulaşana kadar ileri veya geri yönde ilerleyebilir. Dengeye yaklaşmak için ileri yönde ilerleyen reaksiyonlar genellikle kendiliğinden gerçekleşir ve ilerlemek için serbest enerji gerektirmez. Kendiliğinden olmayan reaksiyonlar, ilerlemek için serbest enerji girişi gerektirir (Örnek: Harici bir elektrik güç kaynağı kullanılarak bir pilin şarj edilmesi veya elektromanyetik radyasyonun güneş ışığı şeklinde emilerek fotosentez olayının gerçekleşmesi).
İstenen bir ürünü elde etmek için kimyasal sentez sırasında farklı kombinasyonlarda kimyasal reaksiyonlar kullanılır. Biyokimya (Bir reaksiyona ait ürün, bir sonraki reaksiyonda reaktandır.) kimyasal reaksiyonların birbirini takip ettiği metabolik yollardır. Bu reaksiyonlar genellikle protein enzimleri tarafından katalizlenir. Enzimler biyokimyasal reaksiyonların hızını arttırır, böylece normal koşullar altında gerçekleşmesi imkansız metabolik sentezler ve ayrışmalar bir hücre içindeki sıcaklıklarda ve konsantrasyonlarda gerçekleşebilir.
Kimyasal reaksiyonun genel tanımı, kuantum alan teorisi tarafından tarif edildiği gibi nükleer reaksiyonlar, radyoaktif bozunmalar ve temel parçacıklar arasındaki reaksiyonlar da dahil olmak üzere atomlardan daha küçük maddeler arasında gerçekleşen reaksiyonlara genişletildi.
Kimyasal Denklemlerin Gösterimi
Kimyasal denklemler, kimyasal reaksiyonları grafiksel olarak göstermek için kullanılır. Soldaki reaktanların ve sağdaki ürünlerin kimyasal veya yapısal formüllerinden oluşurlar. Reaksiyonun yönünü ve tipini gösteren bir okla (→) ayrılırlar; ok, “verim” kelimesi olarak okunur. Okun ucu reaksiyonun ilerlediği yönü gösterir. Denge reaksiyonları için zıt yönlere işaret eden çift yönlü ok (⇌) kullanılır. Denklemler stokiyometriye göre dengelenerek her türün atom sayısı denklemin her iki tarafında aynı olmalıdır. Daha ayrıntılı reaksiyonlar, başlangıç materyallerine ve ürünlere ek olarak önemli ara maddeler veya geçiş durumları gösteren reaksiyon şemaları ile gösterilir. Reaksiyona yapıla küçük eklemeler reaksiyon okunun üzerinde gösterilebilir. Bu tür ilaveler; su, ısı, ışık, katalizör, vs.’dir. Benzer şekilde, bazı küçük ürünler genellikle eksi işareti ile okun altına yerleştirilebilir.
Reaksiyon Türleri
Dört temel kimyasal reaksiyon türü vardır; sentez, ayrışma, tek değiştirme ve çift değiştirme.
Sentez: Bir sentez reaksiyonunda, iki veya daha fazla basit madde daha karmaşık bir madde oluşturmak için birleşir. Başka bir tanım olarak, bir ürün oluşturan iki veya daha fazla reaktan, bir sentez reaksiyonudur. Genel biçimi;
A + B → AB
Örnek: Demir (II) sülfit oluşumu için demir ve kükürt kombinasyonu.
Su gibi daha karmaşık bir madde üretmek için oksijen gazı ile hidrojen gazının birleşmesidir.
8Fe +S8 → 8FeS
Ayrışma: Bir ayrışma reaksiyonu, daha karmaşık bir maddenin daha basit parçalarına ayrılmasıdır. Dolayısıyla bir sentez reaksiyonunun zıttıdır. Genel biçimi;
AB → A + B
Örnek: Oksijen ve hidrojen gazı oluşturmak için suyun elektrolizidir.
2H2O → 2H2 + O2
Tek Değiştirme: Tek bir birleşmemiş elemanı bir bileşikte bir değiştirir, başka bir deyişle bir element bir bileşikteki başka bir elementle yer değiştirir. Genel biçimi;
A+ BC → AC + B
Örnek: Magnezyumun sudaki hidrojeni değiştirerek magnezyum hidroksit ve hidrojen gazı oluşturmasıdır.
Mg + 2 H2O → Mg(OH)2 + H2
Çift Değiştirme: Anyonlar ve iki bileşiğin katyonları yer değiştirebilir ve tamamen farklı iki bileşik oluşturabilir. Genel biçimi;
AB + CD → AD + CB
Örnek: Baryum klorür (BaCl2 ) ve magnezyum sülfat (MgSO4 ) reaksiyona SO4 2- anyonu 2Cl ile yer değiştirir – bileşikleri BaSO4 vererek anyon ve MgC2 oluşturur.
Kurşun (II) nitratın , kurşun (II) iyodür ve potasyum nitrat oluşturmak için potasyum iyodür ile reaksiyonu.
Pb(NO3)2 + 2KI → PbI2 + 2KNO3
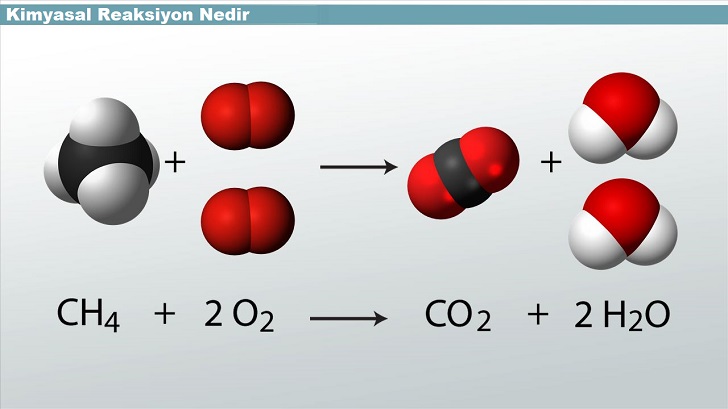
Yanma Reaksiyonu: Bir yanma reaksiyonunda bir element veya bileşik oksijenle reaksiyona girer ve genellikle ısı veya ışık enerjisi üretir. Yanma reaksiyonları her zaman oksijen içerir, ancak her zaman hidrokarbon içermez.
2C8H18(l) + 25 O2(g) → 16CO2 + 18H2O(g)
Bir yanma reaksiyonu, oksijen ile reaksiyona giren karbon , magnezyum veya sülfürden de kaynaklanabilir.
2Mg(s) + O2 → 2MgO(s)
S(s) + O2(g) → SO2(g)
Yükseltgenme ve İndirgenme Reaksiyonu
Sodyum klorür, sodyum metal ve klor gazının redoks reaksiyonu yoluyla oluşur. Redoks reaksiyonları elektronları bir türden ( indirgeyici ajan ) diğerine (oksitleyici ajan ) aktarır. Bu süreçte, önceki tür oksitlenir ve ikincisi indirgenir. İndirgenme reaksiyonları oksidasyon durumundaki artış ve oksidasyon durumundaki azalma olarak tanımlanır. Pratikte, elektronların transferi her zaman oksidasyon durumunu değiştirir ancak hiçbir elektron transferi gerçekleşmese bile (kovalent bağlar) redoks olarak sınıflandırılan birçok reaksiyon vardır.
HA + B
A– + HB+
Ters reaksiyon mümkündür, bu nedenle asit/baz ve konjüge baz/asit her zaman dengededir. Asit ve baz ayrılma sabitleri ( K A ve K B) denge tarafından belirlenir. Asit-baz reaksiyonu tam olarak aynı miktarlarda alınan bir asit ve bir bazın nötr bir tuz oluşturduğu nötralizasyondur.
Asit-baz reaksiyonları kullanılan asit-baz kavramına bağlı olarak farklı tanımlara sahip olabilir. En yaygın olanları;
- Arrhenius tanımı: Asitler suda çözülerek suya H3O+ iyonları verir; bazlar OH– iyonları verir.
- Brønsted-Lowry tanımı: Asitler proton (H +) vericiler, bazlar proton alıcılardır; Arrhenius tanımı da dahildir.
- Lewis tanımı: Asitler elektron çifti alıcılarıdır, bazlar elektron çifti vericileridir; Brønsted-Lowry tanımı da dahildir.
Katı Hal Reaksiyonları
Reaksiyonlar iki katı arasında gerçekleşebilir. Bununla birlikte, katılarda düşük difüzyon hızları nedeniyle reaksiyonlar sıvı ve gaz fazdaki kimyasal reaksiyonlara kıyasla çok yavaştır. Reaksiyon sıcaklığını ve temas eden yüzey alanını arttırmak için reaktantı küçük parçalar halinde ortama eklenir ve reaksiyon hızlandırılır.
Katı | Gaz Arayüzündeki Reaksiyonlar
Reaksiyon katı | gaz arayüzünde ultra yüksek vakumda veya çok düşük basınçta gerçekleşebilir. Taramalı tünelleme mikroskobu(stm) ile reaksiyon zaman ölçeği doğru aralıkta ise gerçek uzayda gaz arayüzündeki katıyı tepkisel gözlemlemek mümkündür. Katı | gaz arayüzündeki reaksiyonlar bazı durumlarda katalizle ilgili olabilir.
Fotokimyasal Reaksiyonlar
Fotokimyasal reaksiyonlar, atomlar ve moleküller enerjinin uyarılmış duruma geçmesidir. Daha sonra kimyasal bağlar kırılır ve bu enerjiyi serbest bırakabilir, böylece radikaller elde edilir. Fotokimyasal reaksiyonlar hidrojen-oksijen reaksiyonları, radikal polimerizasyon , zincir reaksiyonları ve yeniden düzenleme reaksiyonlarını içerir. Birçok önemli süreç fotokimyayı içerir. En önemli örnek, çoğu bitkinin karbondioksit ve suyu glikoza dönüştürmek için güneş enerjisini kullanması ve oksijeni bir yan ürün olarak atmosfere bıraktığı fotosentezdir. Ozon oluşumu gibi birçok önemli fotokimyasal reaksiyon Dünya atmosferinde meydana gelir.
Hazırlayan: Rabiye Baştürk


